Expo
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. QuirúrgicaCuidados de PacientesTIPruebas POC
Eventos

- Modelo de predicción con IA mejora la toma de decisiones sobre transfusiones de sangre en pacientes de UCI
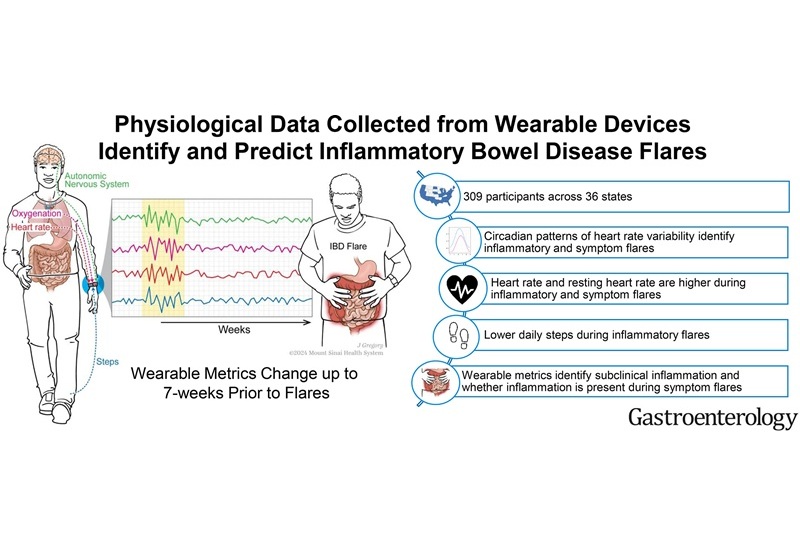
- Los dispositivos portátiles detectan y predicen los brotes de enfermedad inflamatoria intestinal
- Técnica innovadora detiene los latidos irregulares del corazón
- Modelo de IA predice con precisión la progresión de enfermedades autoinmunes
- La IA predice e identifica subtipos de diabetes tipo 2 utilizando monitores continuos de glucosa en sangre
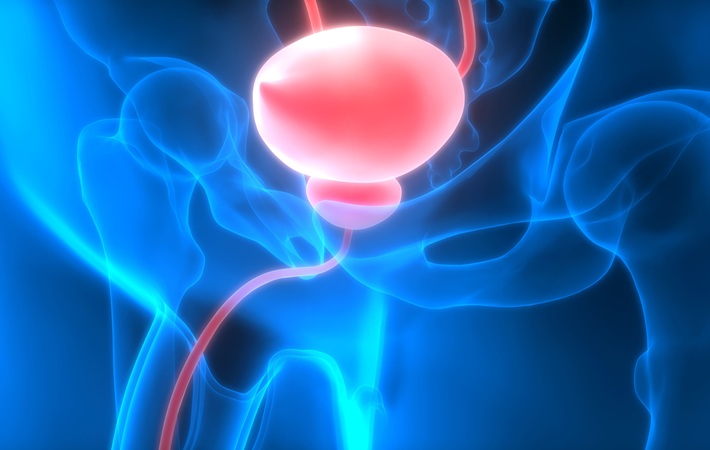
- Nueva técnica de imagen, un cambio radical para la cirugía del cáncer de vejiga
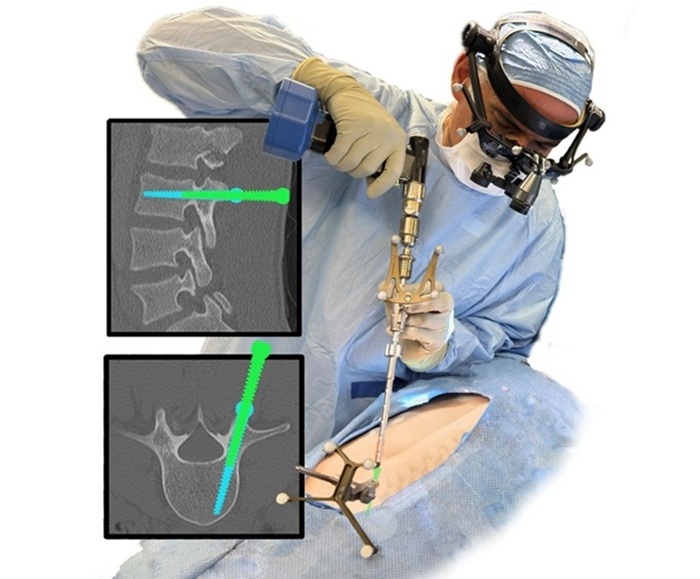
- Material sintético para uso en cirugía de columna revoluciona la tecnología de injertos óseos
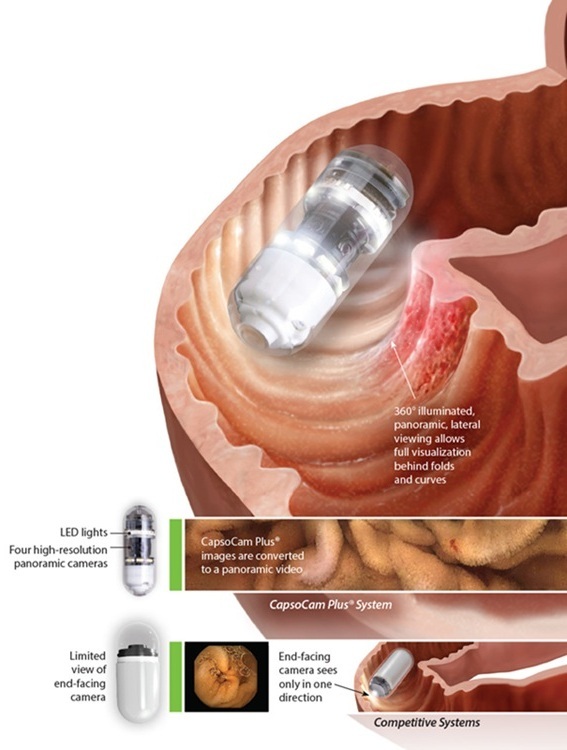
- Primer sistema de cápsula endoscópica del mundo con cuatro cámaras ofrece imágenes panorámicas
- Molécula de origen vegetal previene formación de biopelículas bacterianas en catéteres e implantes
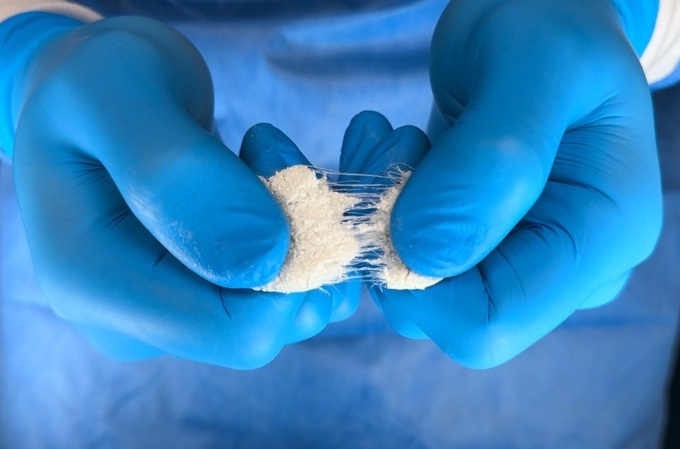
- Nuevo biomaterial de 'andamiaje’ mejora la regeneración y función de la vejiga
- Tecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
- Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
- Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
- Cama para UCI de próxima generación ayuda a abordar necesidades complejas de cuidados intensivos
- Innovadora tecnología de desinfección UV-C impulsada por IA redefine el panorama del control de infecciones
- MEDICA 2024 destacará los temas más candentes de la industria MedTech
- Empresas emergentes volverán a ser protagonistas en MEDICA 2024
- Boston Scientific adquirirá la empresa de ablación de fibrilación auricular Cortex
- Hologic adquiere Gynesonics para fortalecer su negocio quirúrgico ginecológico existente
- Smith+Nephew y JointVue se asocian en la planificación preoperatoria por ultrasonido en cirugía robótica
- Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
- Solución de quirófanos habilitada para IA ayuda a hospitales a maximizar la utilización y desbloquear la capacidad
- IA predice cáncer de páncreas tres años antes del diagnóstico a partir de registros médicos de los pacientes
- Primer sistema de autorizaciones médicas personalizadas de IA generativa totalmente autónoma reduce el retraso en la atención
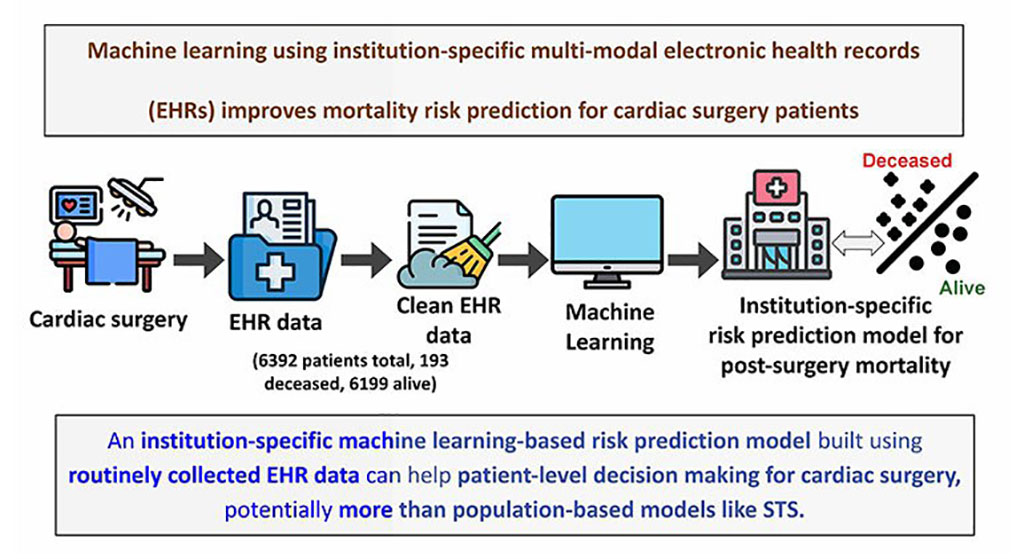
- Según un estudio, registros médicos electrónicos pueden ser clave para mejorar la atención al paciente
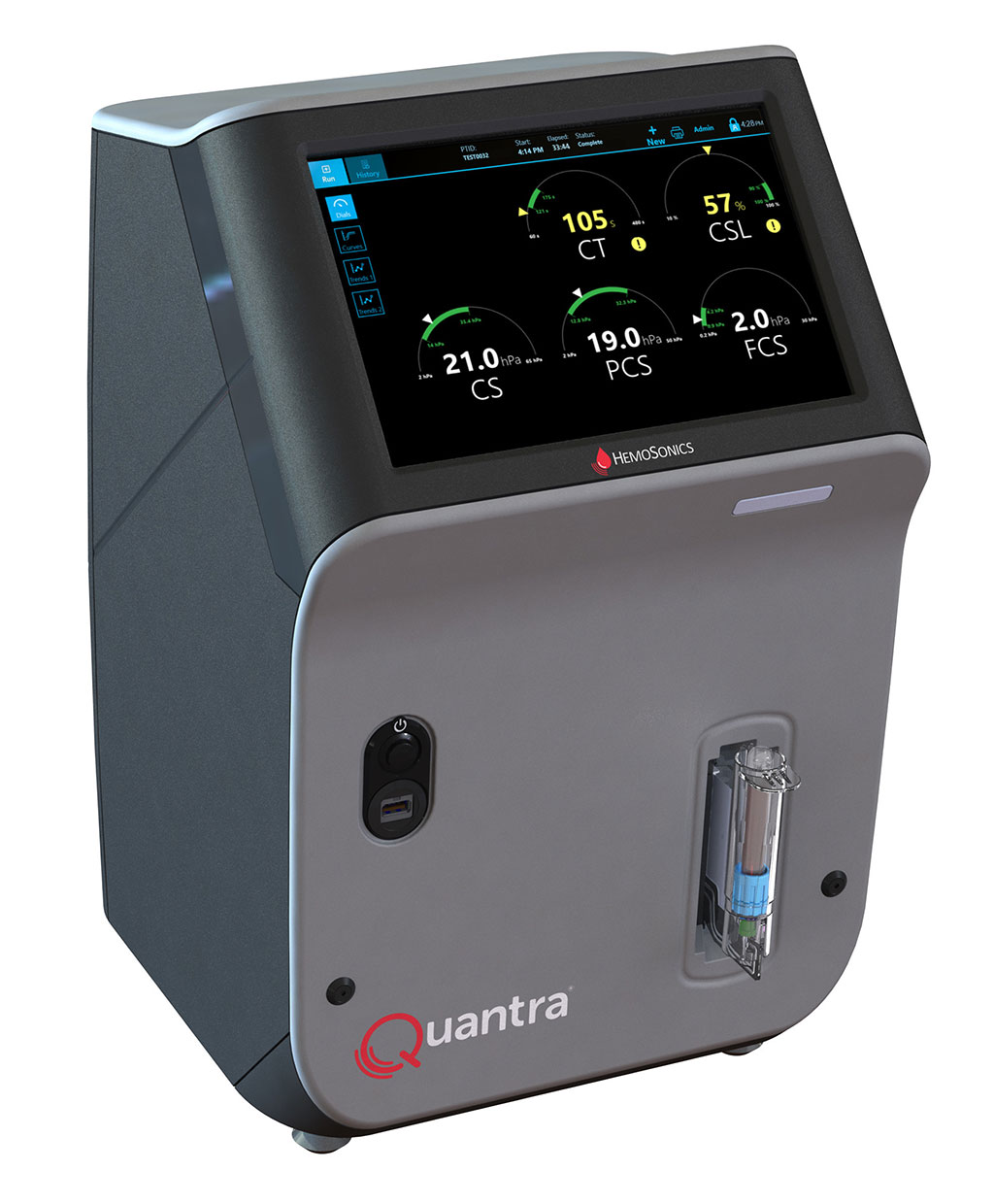
- Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
- Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
- Mercado mundial de pruebas de cabecera será testigo de perspectivas prometedoras en cuidados intensivos
- Mercado mundial de diagnóstico de sepsis impulsado por el aumento de enfermedades adquiridas en hospitales

Expo
 ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. QuirúrgicaCuidados de PacientesTIPruebas POC
Eventos
Publique su anuncio con nosotros
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. QuirúrgicaCuidados de PacientesTIPruebas POC
Eventos
Publique su anuncio con nosotros


- Modelo de predicción con IA mejora la toma de decisiones sobre transfusiones de sangre en pacientes de UCI
- Los dispositivos portátiles detectan y predicen los brotes de enfermedad inflamatoria intestinal
- Técnica innovadora detiene los latidos irregulares del corazón
- Modelo de IA predice con precisión la progresión de enfermedades autoinmunes
- La IA predice e identifica subtipos de diabetes tipo 2 utilizando monitores continuos de glucosa en sangre
- Nueva técnica de imagen, un cambio radical para la cirugía del cáncer de vejiga
- Material sintético para uso en cirugía de columna revoluciona la tecnología de injertos óseos
- Primer sistema de cápsula endoscópica del mundo con cuatro cámaras ofrece imágenes panorámicas
- Molécula de origen vegetal previene formación de biopelículas bacterianas en catéteres e implantes
- Nuevo biomaterial de 'andamiaje’ mejora la regeneración y función de la vejiga
- Tecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
- Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
- Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
- Cama para UCI de próxima generación ayuda a abordar necesidades complejas de cuidados intensivos
- Innovadora tecnología de desinfección UV-C impulsada por IA redefine el panorama del control de infecciones
- MEDICA 2024 destacará los temas más candentes de la industria MedTech
- Empresas emergentes volverán a ser protagonistas en MEDICA 2024
- Boston Scientific adquirirá la empresa de ablación de fibrilación auricular Cortex
- Hologic adquiere Gynesonics para fortalecer su negocio quirúrgico ginecológico existente
- Smith+Nephew y JointVue se asocian en la planificación preoperatoria por ultrasonido en cirugía robótica
- Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
- Solución de quirófanos habilitada para IA ayuda a hospitales a maximizar la utilización y desbloquear la capacidad
- IA predice cáncer de páncreas tres años antes del diagnóstico a partir de registros médicos de los pacientes
- Primer sistema de autorizaciones médicas personalizadas de IA generativa totalmente autónoma reduce el retraso en la atención
- Según un estudio, registros médicos electrónicos pueden ser clave para mejorar la atención al paciente
- China aprueba la primera vacuna inhalable contra la COVID-19 del mundo
- Vacuna en parche contra la COVID-19 combate variantes del SARS-CoV-2 mejor que las agujas
- Pruebas de viscosidad sanguínea predicen riesgo de muerte en pacientes hospitalizados con COVID-19
- ‘Computadora Covid’ usa IA para detectar COVID-19 en exámenes de TC de tórax
- Técnica de resonancia magnética muestra la causa de los síntomas de COVID prolongada
- Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
- Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
- Mercado mundial de pruebas de cabecera será testigo de perspectivas prometedoras en cuidados intensivos
- Mercado mundial de diagnóstico de sepsis impulsado por el aumento de enfermedades adquiridas en hospitales