Expo
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. Quirúrgica
TIPruebas POCNegocios
Eventos

- Sistema de puntuación impulsado por IA evalúa la insuficiencia cardíaca con fracción de eyección preservada
- Colonoscopia asistida por IA detecta más pólipos, pero muestra poco impacto en el riesgo de cáncer
- Nueva tecnología reduce la necesidad de anticoagulantes continuos en pacientes con fibrilación auricular
- Modelo de IA proporciona alertas de riesgo de sepsis en tiempo real
- Algoritmo de IA mejora la nutrición intravenosa de bebés prematuros
- Pequeñas herramientas robóticas permiten cirugías cerebrales mínimamente invasivas
- Innovadoras pinzas magnéticas hacen que la cirugía robótica sea más segura y precisa
- Herramienta de planificación quirúrgica impulsada por IA mejora la planificación preoperatoria
- Sistema de sensores restaura el sentido del tacto en la cirugía mínimamente invasiva
- Sistema de navegación con realidad aumentada mejora la colocación de DVE
- Tecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
- Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
- Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
- Cama para UCI de próxima generación ayuda a abordar necesidades complejas de cuidados intensivos
- Innovadora tecnología de desinfección UV-C impulsada por IA redefine el panorama del control de infecciones
- Boston Scientific adquiere la empresa de dispositivos médicos SoniVie
- Teleflex adquirirá el negocio de intervención vascular de BIOTRONIK
- El Congreso Mundial de Hospitales de 2026 se celebrará en Seúl
- Philips y Mass General Brigham colaboran para mejorar la atención al paciente con información en tiempo real impulsada por IA
- Boston Scientific adquiere la empresa de dispositivos médicos Intera Oncology
- Los relojes inteligentes podrían detectar la insuficiencia cardíaca congestiva
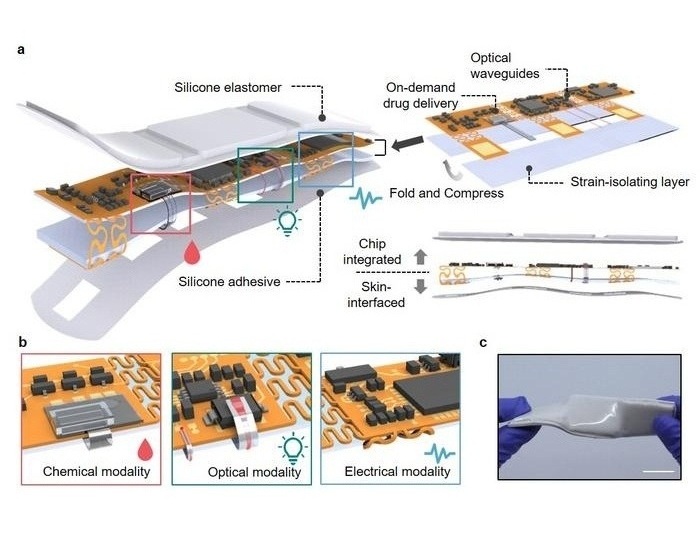
- Un parche inteligente versátil combina monitoreo de salud y administración de fármacos
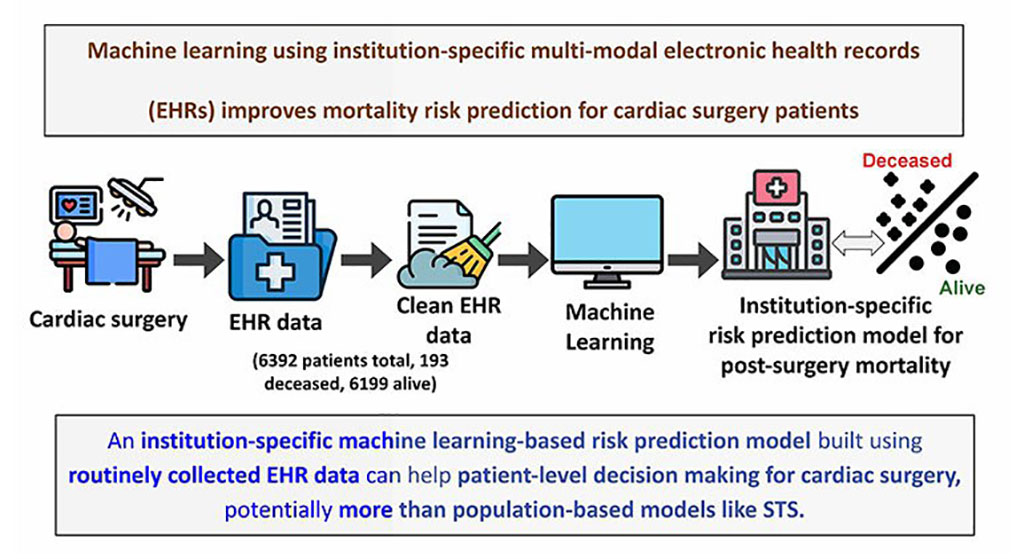
- Modelo de aprendizaje automático mejora predicción del riesgo de mortalidad para pacientes de cirugía cardíaca
- Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
- Solución de quirófanos habilitada para IA ayuda a hospitales a maximizar la utilización y desbloquear la capacidad
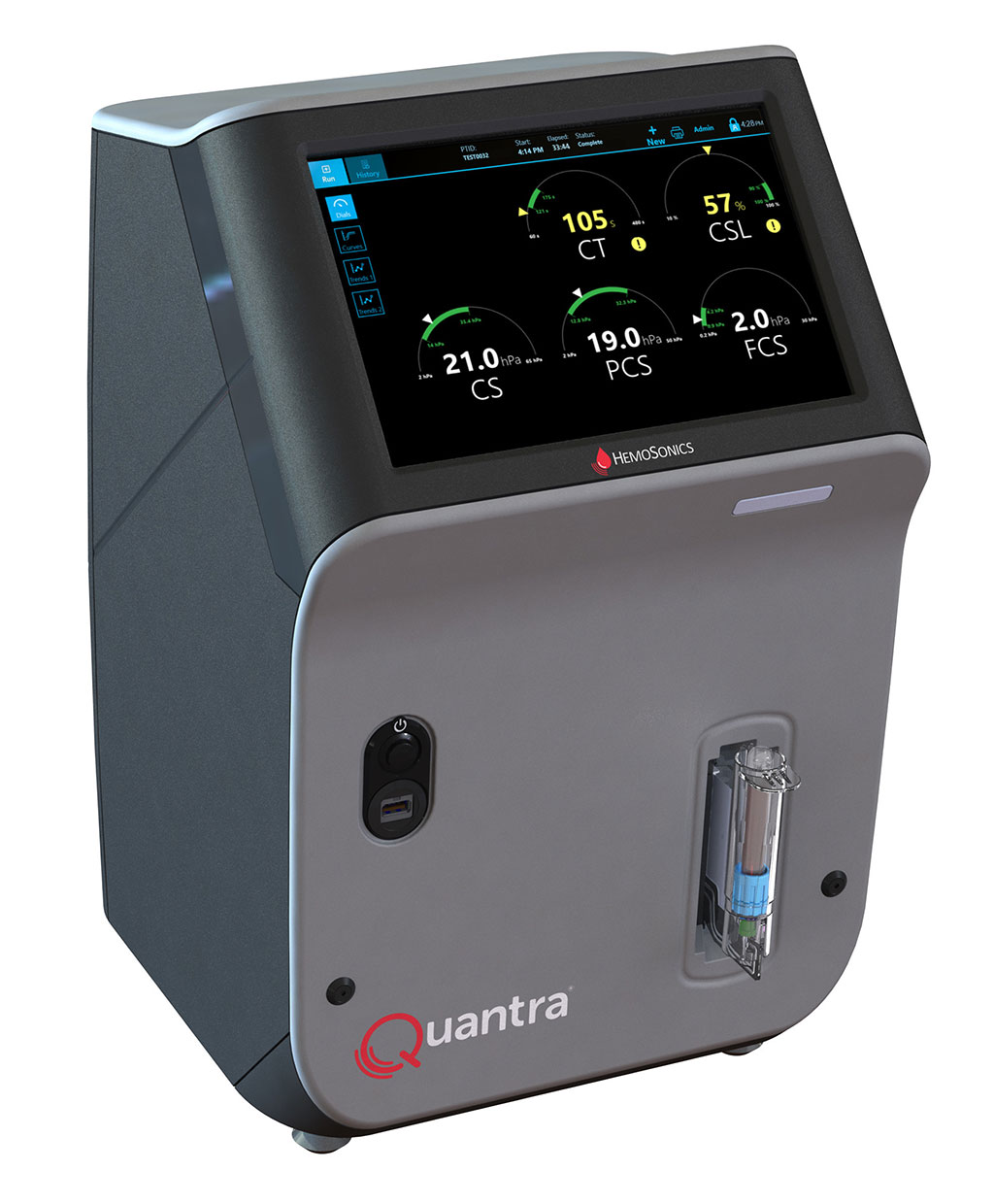
- Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
- Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
- Mercado mundial de pruebas de cabecera será testigo de perspectivas prometedoras en cuidados intensivos
- Mercado mundial de diagnóstico de sepsis impulsado por el aumento de enfermedades adquiridas en hospitales

Expo
 ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. Quirúrgica
TIPruebas POCNegocios
Eventos
Publique su anuncio con nosotros
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
ver canal
Imagenología
Cuidados CriticosTéc. Quirúrgica
TIPruebas POCNegocios
Eventos
Publique su anuncio con nosotros


- Sistema de puntuación impulsado por IA evalúa la insuficiencia cardíaca con fracción de eyección preservada
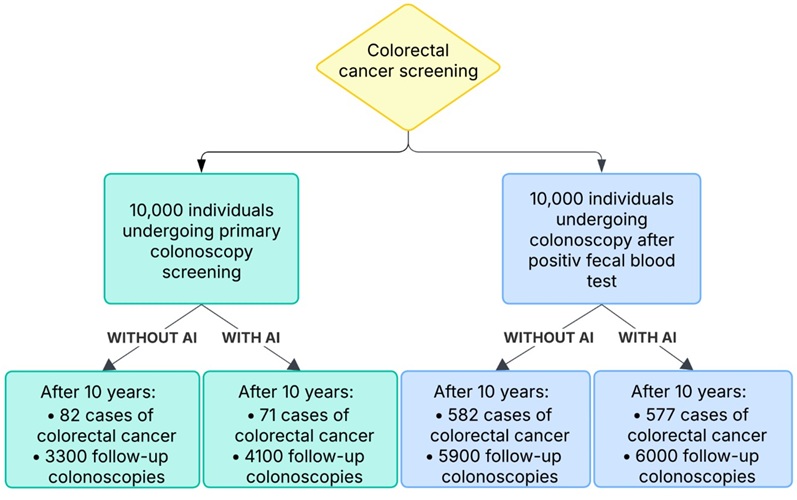
- Colonoscopia asistida por IA detecta más pólipos, pero muestra poco impacto en el riesgo de cáncer
- Nueva tecnología reduce la necesidad de anticoagulantes continuos en pacientes con fibrilación auricular
- Modelo de IA proporciona alertas de riesgo de sepsis en tiempo real
- Algoritmo de IA mejora la nutrición intravenosa de bebés prematuros
- Pequeñas herramientas robóticas permiten cirugías cerebrales mínimamente invasivas
- Innovadoras pinzas magnéticas hacen que la cirugía robótica sea más segura y precisa
- Herramienta de planificación quirúrgica impulsada por IA mejora la planificación preoperatoria
- Sistema de sensores restaura el sentido del tacto en la cirugía mínimamente invasiva
- Sistema de navegación con realidad aumentada mejora la colocación de DVE
- Tecnología portátil de luz germicida, única en su tipo, desinfecta superficies clínicas de alto contacto en segundos
- Solución de optimización de la capacidad quirúrgica ayuda a hospitales a impulsar utilización de quirófanos
- Innovación revolucionaria en esterilización de instrumentos quirúrgicos mejora significativamente rendimiento del quirófano
- Cama para UCI de próxima generación ayuda a abordar necesidades complejas de cuidados intensivos
- Innovadora tecnología de desinfección UV-C impulsada por IA redefine el panorama del control de infecciones
- Boston Scientific adquiere la empresa de dispositivos médicos SoniVie
- Teleflex adquirirá el negocio de intervención vascular de BIOTRONIK
- El Congreso Mundial de Hospitales de 2026 se celebrará en Seúl
- Philips y Mass General Brigham colaboran para mejorar la atención al paciente con información en tiempo real impulsada por IA
- Boston Scientific adquiere la empresa de dispositivos médicos Intera Oncology
- Los relojes inteligentes podrían detectar la insuficiencia cardíaca congestiva
- Un parche inteligente versátil combina monitoreo de salud y administración de fármacos
- Modelo de aprendizaje automático mejora predicción del riesgo de mortalidad para pacientes de cirugía cardíaca
- Colaboración estratégica para desarrollar e integrar IA generativa en el cuidado de la salud
- Solución de quirófanos habilitada para IA ayuda a hospitales a maximizar la utilización y desbloquear la capacidad
- China aprueba la primera vacuna inhalable contra la COVID-19 del mundo
- Vacuna en parche contra la COVID-19 combate variantes del SARS-CoV-2 mejor que las agujas
- Pruebas de viscosidad sanguínea predicen riesgo de muerte en pacientes hospitalizados con COVID-19
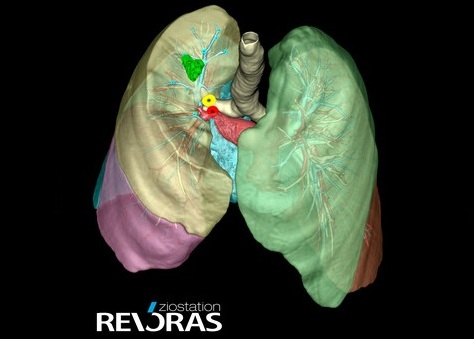
- ‘Computadora Covid’ usa IA para detectar COVID-19 en exámenes de TC de tórax
- Técnica de resonancia magnética muestra la causa de los síntomas de COVID prolongada
- Sistema de hemostasia de sangre total POC de última generación reconoce necesidades específicas de servicios de emergencia y quirófanos
- Laboratorio portátil permitirá identificación de infecciones bacterianas más rápida y económica en el punto de necesidad
- Mercado mundial de pruebas de cabecera será testigo de perspectivas prometedoras en cuidados intensivos
- Mercado mundial de diagnóstico de sepsis impulsado por el aumento de enfermedades adquiridas en hospitales